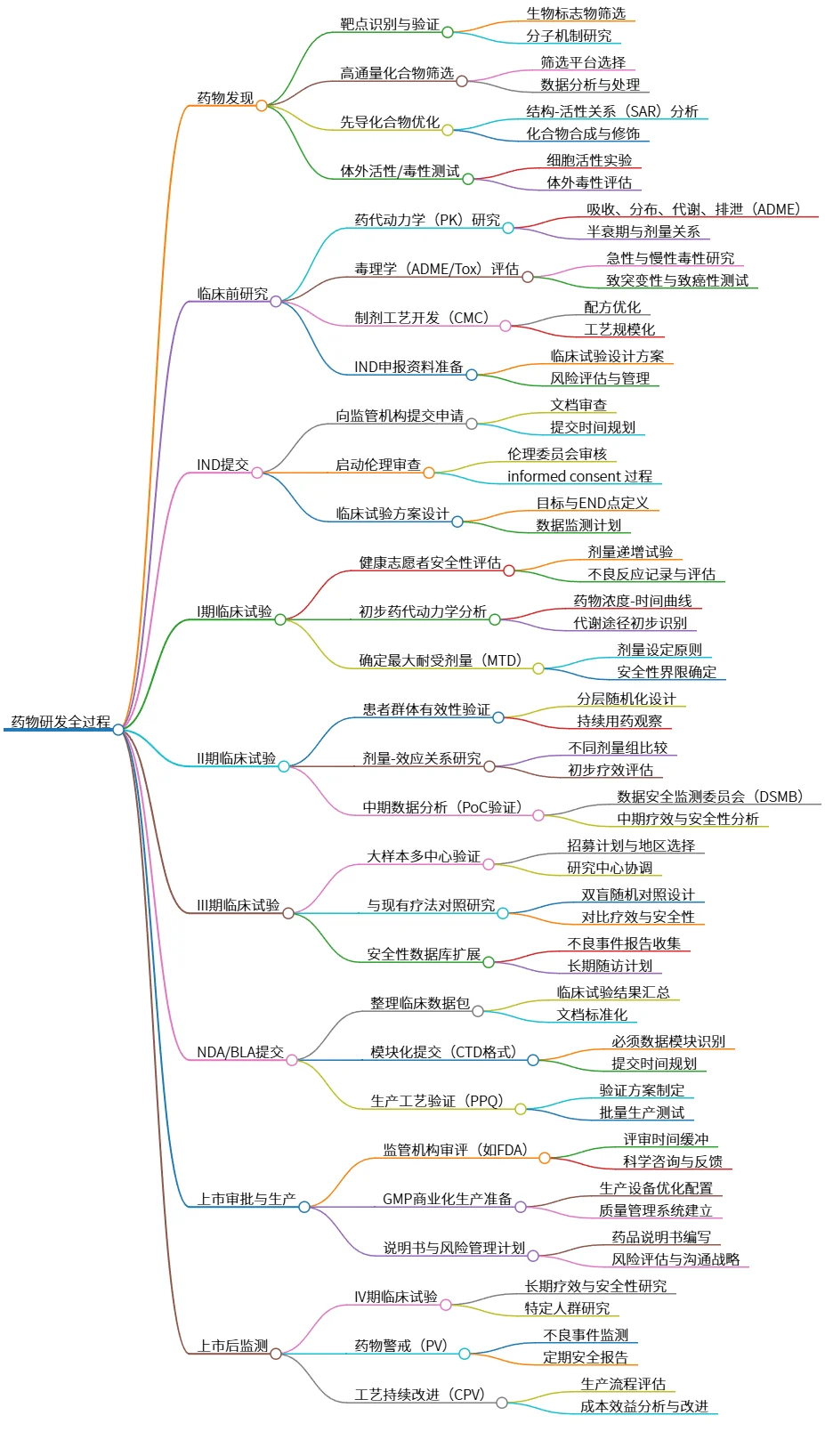
药物研发全过程:从发现到上市后监测的全景概述
该思维导图详细展示了药物研发的全过程,包括药物发现、临床前研究、IND提交、临床试验及上市后监测等多个阶段。在药物发现阶段,有靶点识别、高通量筛选等过程;临床前研究注重药代动力学和毒理学评估;临床试验分为I期至III期,验证安全性和有效性;最终通过NDA/BLA提交进行上市审批,上市后需进行持续监测与改进。该流程确保药物安全有效地推向市场。
源码
# 药物研发全过程
## 药物发现
### 靶点识别与验证
- 生物标志物筛选
- 分子机制研究
### 高通量化合物筛选
- 筛选平台选择
- 数据分析与处理
### 先导化合物优化
- 结构-活性关系(SAR)分析
- 化合物合成与修饰
### 体外活性/毒性测试
- 细胞活性实验
- 体外毒性评估
## 临床前研究
### 药代动力学(PK)研究
- 吸收、分布、代谢、排泄(ADME)
- 半衰期与剂量关系
### 毒理学(ADME/Tox)评估
- 急性与慢性毒性研究
- 致突变性与致癌性测试
### 制剂工艺开发(CMC)
- 配方优化
- 工艺规模化
### IND申报资料准备
- 临床试验设计方案
- 风险评估与管理
## IND提交
### 向监管机构提交申请
- 文档审查
- 提交时间规划
### 启动伦理审查
- 伦理委员会审核
- informed consent 过程
### 临床试验方案设计
- 目标与END点定义
- 数据监测计划
## I期临床试验
### 健康志愿者安全性评估
- 剂量递增试验
- 不良反应记录与评估
### 初步药代动力学分析
- 药物浓度-时间曲线
- 代谢途径初步识别
### 确定最大耐受剂量(MTD)
- 剂量设定原则
- 安全性界限确定
## II期临床试验
### 患者群体有效性验证
- 分层随机化设计
- 持续用药观察
### 剂量-效应关系研究
- 不同剂量组比较
- 初步疗效评估
### 中期数据分析(PoC验证)
- 数据安全监测委员会(DSMB)
- 中期疗效与安全性分析
## III期临床试验
### 大样本多中心验证
- 招募计划与地区选择
- 研究中心协调
### 与现有疗法对照研究
- 双盲随机对照设计
- 对比疗效与安全性
### 安全性数据库扩展
- 不良事件报告收集
- 长期随访计划
## NDA/BLA提交
### 整理临床数据包
- 临床试验结果汇总
- 文档标准化
### 模块化提交(CTD格式)
- 必须数据模块识别
- 提交时间规划
### 生产工艺验证(PPQ)
- 验证方案制定
- 批量生产测试
## 上市审批与生产
### 监管机构审评(如FDA)
- 评审时间缓冲
- 科学咨询与反馈
### GMP商业化生产准备
- 生产设备优化配置
- 质量管理系统建立
### 说明书与风险管理计划
- 药品说明书编写
- 风险评估与沟通战略
## 上市后监测
### IV期临床试验
- 长期疗效与安全性研究
- 特定人群研究
### 药物警戒(PV)
- 不良事件监测
- 定期安全报告
### 工艺持续改进(CPV)
- 生产流程评估
- 成本效益分析与改进
图片