氨的制备、性质及应用全方位解析
该思维导图概述了氨(NH₃)的制备方法、分子结构、物理和化学性质,以及铵盐的特性和其他相关特性。氨可通过实验室制法和氯化物水解制备,呈无色刺激性气体,极易溶于水,具有较强的极性。其化学性质包括配位反应、取代反应和氧化反应。氨与酸反应形成铵盐,具有良好的水溶性和电解质特性,其工业应用涵盖硝酸生产、制冷剂和肥料原料等。
源码
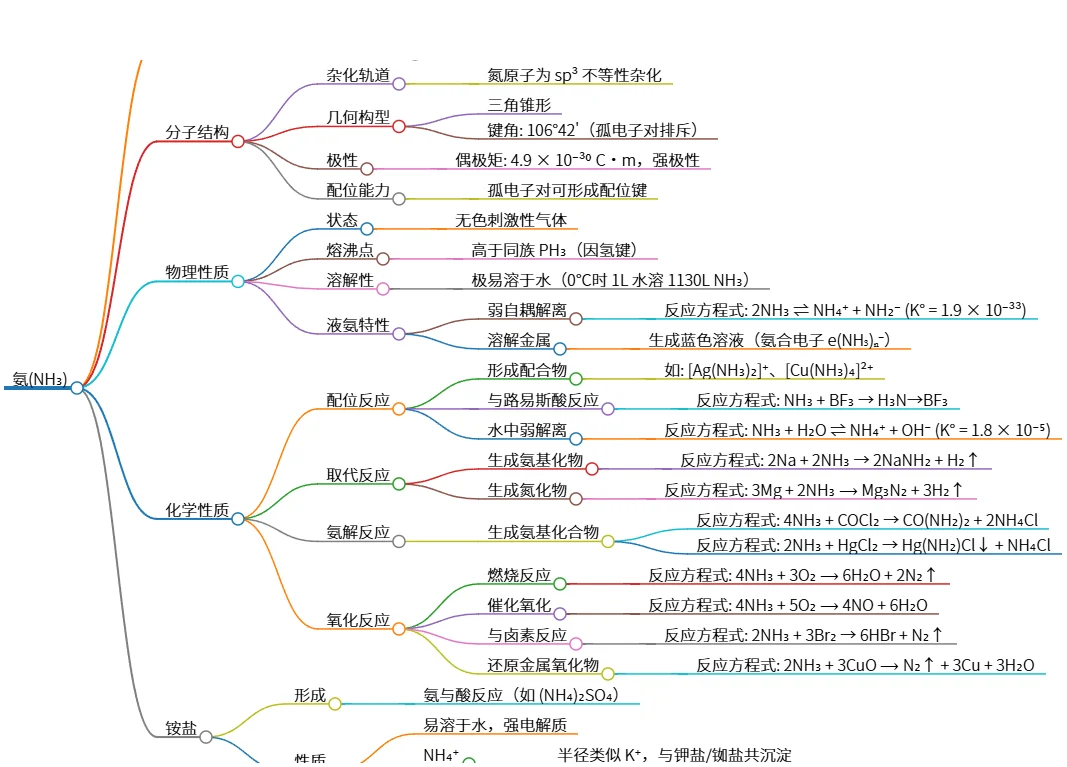
# 氨(NH₃)
## 制备方法
- 实验室制法
- 反应方程式: 2NH₄Cl + Ca(OH)₂ ⟶ CaCl₂ + 2NH₃↑ + 2H₂O
- 氯化物水解
- 反应方程式: Mg₃N₂ + 6H₂O ⟶ 3Mg(OH)₂ + 2NH₃↑
## 分子结构
- 杂化轨道
- 氮原子为 sp³ 不等性杂化
- 几何构型
- 三角锥形
- 键角: 106°42'(孤电子对排斥)
- 极性
- 偶极矩: 4.9 × 10⁻³⁰ C·m,强极性
- 配位能力
- 孤电子对可形成配位键
## 物理性质
- 状态
- 无色刺激性气体
- 熔沸点
- 高于同族 PH₃(因氢键)
- 溶解性
- 极易溶于水(0℃时 1L 水溶 1130L NH₃)
- 液氨特性
- 弱自耦解离
- 反应方程式: 2NH₃ ⇌ NH₄⁺ + NH₂⁻ (K° = 1.9 × 10⁻³³)
- 溶解金属
- 生成蓝色溶液(氨合电子 e(NH₃)ₙ⁻)
## 化学性质
- 配位反应
- 形成配合物
- 如: [Ag(NH₃)₂]⁺、[Cu(NH₃)₄]²⁺
- 与路易斯酸反应
- 反应方程式: NH₃ + BF₃ → H₃N→BF₃
- 水中弱解离
- 反应方程式: NH₃ + H₂O ⇌ NH₄⁺ + OH⁻ (K° = 1.8 × 10⁻⁵)
- 取代反应
- 生成氨基化物
- 反应方程式: 2Na + 2NH₃ → 2NaNH₂ + H₂↑
- 生成氮化物
- 反应方程式: 3Mg + 2NH₃ ⟶ Mg₃N₂ + 3H₂↑
- 氨解反应
- 生成氨基化合物
- 反应方程式: 4NH₃ + COCl₂ → CO(NH₂)₂ + 2NH₄Cl
- 反应方程式: 2NH₃ + HgCl₂ → Hg(NH₂)Cl↓ + NH₄Cl
- 氧化反应
- 燃烧反应
- 反应方程式: 4NH₃ + 3O₂ ⟶ 6H₂O + 2N₂↑
- 催化氧化
- 反应方程式: 4NH₃ + 5O₂ ⟶ 4NO + 6H₂O
- 与卤素反应
- 反应方程式: 2NH₃ + 3Br₂ → 6HBr + N₂↑
- 还原金属氧化物
- 反应方程式: 2NH₃ + 3CuO ⟶ N₂↑ + 3Cu + 3H₂O
## 铵盐
- 形成
- 氨与酸反应(如 (NH₄)₂SO₄)
- 性质
- 易溶于水,强电解质
- NH₄⁺
- 半径类似 K⁺,与钾盐/铷盐共沉淀
- 水解性
- 强酸铵盐显酸性(如 NH₄Cl)
- 弱酸铵盐双水解(如 (NH
图片